暗网禁区 熊炜助理教授、李颖讲师在Chemical Engineering Journal发表口服递送siRNA研究成果
暗网禁区 药学院熊炜助理教授、李颖讲师和澳门大学余华教授合作,在口服递送siRNA研究上取得进展,成果发表在化学工程领域权威期刊《Chemical Engineering Journal》(影响因子13.2,中科院一区,TOP期刊),标题为“Arginase-1 responsive lipid nanoparticles for cytosolic TNF-a-siRNA release to alleviate colitis”。暗网禁区 21级药学专业硕士研究生张翠花、澳门大学24级博士研究生姚雅文为共同第一作者,熊炜助理教授、李颖讲师和余华教授为共同通讯作者,深圳大学为第一通讯单位。

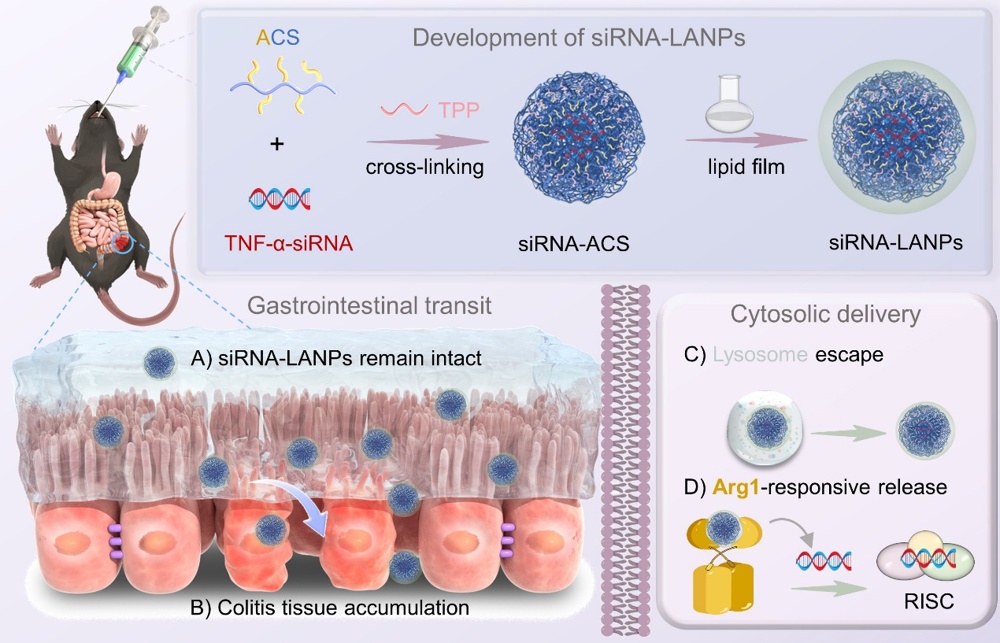
高效胞内递送小干扰RNA(siRNA)仍是RNA治疗领域的一项重大挑战,尤其在口服给药方面。因此,开发胞内响应释药的新靶标对于优化siRNA递送系统具有重要意义。鉴于炎性结肠黏膜中精氨酸酶1(Arg1)表达水平显著升高,我们开发了一种以精氨酸修饰壳聚糖(ACS)为载体、用于递送TNF-α siRNA的脂质纳米粒(siRNA-LANPs),以治疗溃疡性结肠炎。与天然底物L-精氨酸相比,siRNA-LANPs表现出更强的Arg1结合亲和力,可实现快速的Arg1响应释放。siRNA-LANPs在模拟消化液中12 h内保持纳米结构完整,对负载siRNA的保护率高达84.5%。口服给药后,siRNA-LANPs能有效穿透结肠黏液层,并优先富集于炎性结肠组织而非健康组织。在结肠炎小鼠模型中,siRNA-LANPs通过高效沉默TNF-α,显著减轻炎症严重程度,疗效优于临床一线药物柳氮磺吡啶。与转染试剂Lipo3000和TNF-α生物制剂英夫利昔单抗相比,siRNA-LANPs也表现出更优异的TNF-α沉默效率。其性能提升归因于多途径内吞作用、高溶酶体逃逸效率(29.7%)以及Arg1介导的胞质siRNA释放。综上,Arg1可作为溃疡性结肠炎治疗中一种理想的内源性刺激响应靶点,为实现口服siRNA递送提供新策略。
本研究得到国家自然科学基金、深圳市科创委和深圳大学新引进教师启动经费的资助。
原文链接://doi.org/10.1016/j.cej.2025.168039










用户登录
还没有账号?
立即注册